

美国化学会志(J. Am. Chem. Soc. 2018, 140, 16589−16595)在线发表了我院食品安全与生物分析教育部重点实验室的论文(Article),报道了在活细胞特定蛋白糖基化检测领域取得重要研究进展。论文题目为“Amplified Visualization of Protein-specific Glycosylation in Zebrafish via Proximity-induced Hybridization Chain Reaction” [第一作者为李婧影老师,共通讯作者为我院李娟教授和杨黄浩教授]。
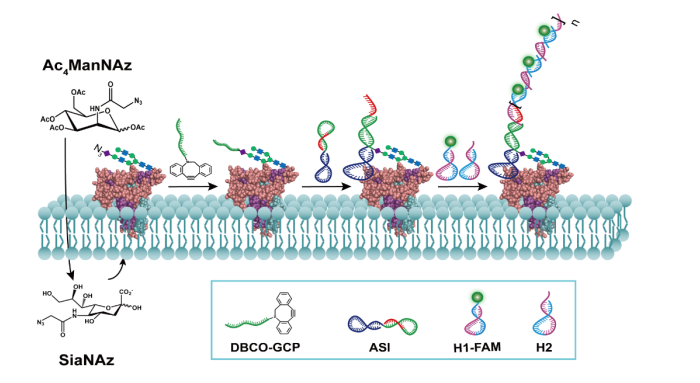
众所周知,糖基化是一类广泛存在于绝大多数真核细胞中的复杂的蛋白质翻译后修饰,参与了许多重要的生理过程。细胞表面特定蛋白糖基化的可视化研究对于在细胞动态生理环境下阐明蛋白糖基化的功能是至关重要的。近年来发展的一些联合化学手段的荧光标记技术,利用FRET技术实现特定蛋白糖基化的可视化检测。然而,FRET成像方式普遍存在背景信号高、效率低、选择合适供体/受体荧光分子对上存在困难等问题。
针对这些问题,本文作者通过结合DNA邻近杂交和杂交链反应(HCR),设计了一种邻近诱导HCR策略用于活细胞表面特定蛋白糖基化放大成像。该方法通过设计糖基标记探针和蛋白识别探针实现了活细胞表面PTK7蛋白以及EpCAM蛋白特异性的糖基化检测,并利用探针间的邻近杂交引发HCR实现信号放大,能够灵敏地检测不同浓度药物作用下蛋白糖基化水平的变化。该方法简便、快速地进行特定蛋白糖基的标记,无需复杂费时的基因工程修饰目标蛋白;适用于不同的生物样本,如活细胞、斑马鱼等,有望用于实际临床样品的分析。因此,所构建的放大成像新方法在深入研究特定蛋白糖基化在相关疾病发展中的作用具有良好的应用前景。
这个工作为开发灵敏、高效的特定蛋白糖基化检测策略提供了一条新思路,特别是在活细胞甚至活体中实现实时动态检测中具有重要意义。该研究工作得到国家自然科学基金(Nos. 21622502, 21475026, 21505021, 21605023),福建省自然科学基金(Nos. 2016J05035, 2017J06004),长江学者与创新团队发展计划(No. IRT15R11)等资助。
论文链接:https://pubs.acs.org/doi/abs/10.1021%2Fjacs.8b08442